您的购物车目前是空的!
描述
支原体检测试剂盒-科研版
【产品货号及规格】
BPM 20-01 20 T/盒
【产品说明】
支原体(Mycoplasma):目前发现的最小的原核生物,据统计约 15~35% 的细胞被支原体污染。支原体污染会改变宿主细胞的结构与功能,易致实验结果不稳定,须对培养细胞定期进行支原体检测。
本产品试剂盒采用多套引物探针在 FAM 通道检测支原体 DNA,采用一套引物探针在 VIC 通道检测内参 DNA,检测对象为细胞培养的上清液或细胞本身。该试剂盒具有以下特点:
稳定:全程闭管操作,无交叉污染。
可靠:含内参基因,避免假阴性。
方便:操作简单,无需电泳步骤。
定量:以 Ct 值判断,可定量检测。
【运输及保存条件】
低温冷冻运输,-20 ℃保存,有效期 1 年。
【产品组分】
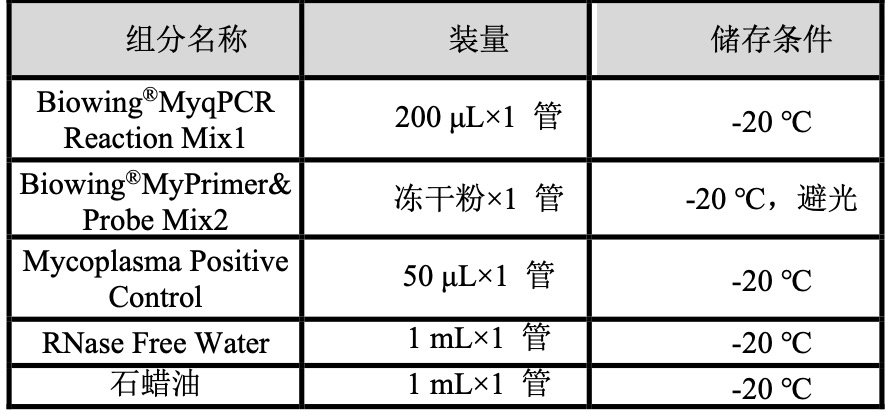
注:本试剂盒提供试剂,使用前先低速离心后小心开启。使用时请上下轻柔颠倒十次混匀,避免起泡,并低速短暂离心后使用。
【操作步骤】
1.试剂的复溶
Biowing®MyPrimer&Probe Mix2 先12,000 rpm离心5 min,再用179 μL/管RNase Free Water复溶,混匀1 min ,瞬离,并常温放置5-10 min后备用。
2.样本制备(自备)
样本可直扩,具体操作方法见附录2。
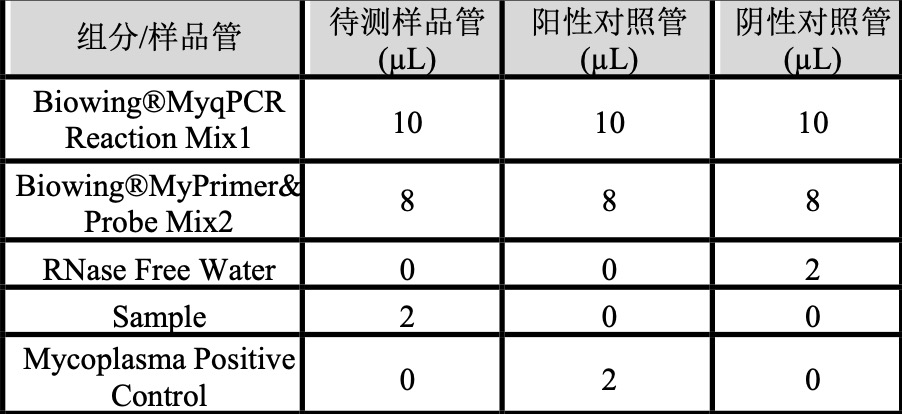
3.qPCR 反应体系及条件反应体系以20 µL为例:
- 震荡混匀 qPCR Mix,低速离心,将管盖残留液体收集至管底。
- 向每孔反应管中分装 18 μL qPCR Mix。
- 向已分装过 qPCR Mix 的反应管中加入15 μL石蜡油。
- 向反应管中穿过石蜡油层加样,3000 rpm 瞬离5 s,加样示例如下:
PCR 仪设置
以ABI 7500为例,选择TaqMan 探针法:
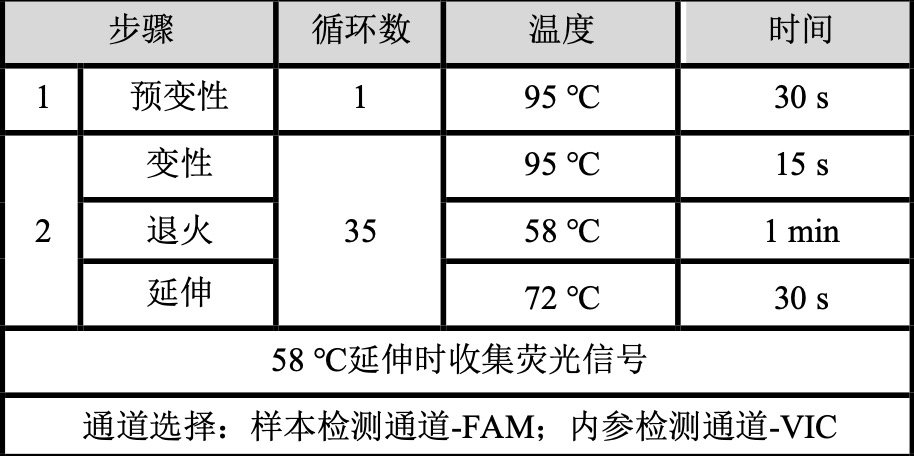
注:建议其他不同类型样本,先做适应性验证,因为不同样本杂质性质不同。
【阈值设置】
以ABI 7500为例,扩增曲线选择 log 法,基线设置 3~15 个循环。
1.内参(VIC)阈值设定:以阴性对照定内参扩增曲线阈值,将内参的 Ct 值定为 30±3。
2.支原体(FAM)阈值设定:以阳性对照定支原体扩增曲线阈值,将支原体(FAM)的 Ct 值定为 26±3。
【结果判读】
根据支原体(FAM) Ct 值判定是否发生支原体污染,具体标准如下:
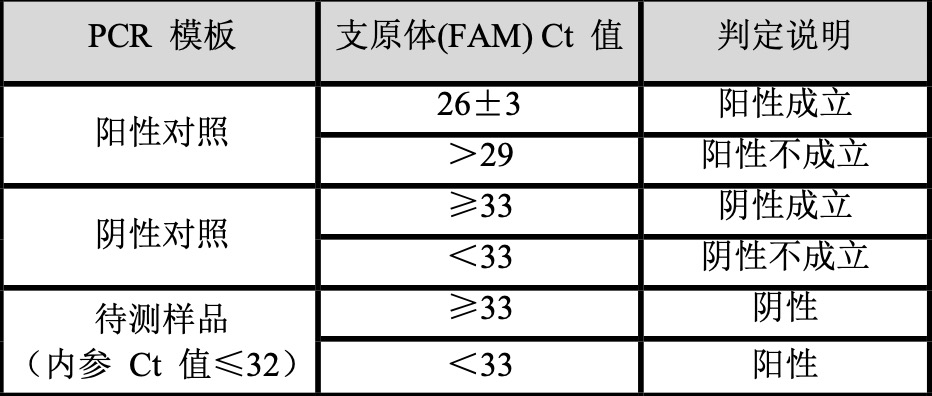
注:检测结果与其他方法检测结果矛盾时:
1.检查内参通道扩增是否正常,扩增曲线是否选择 log 法。
2.内参扩增不正常,表明 PCR 反应未正常进行,PCR 体系受到干扰,需重复检测。
3.内参扩增正常,结合 Ct 值和扩增曲线形态判断。
4.无典型扩增曲线,可认为该样本为支原体阴性。有典型扩增曲线,需重复检测。重复结果不一致判为阴性;结果一致,判为阳性。
【注意事项】
由于 PCR 反应非常灵敏,实验操作中应注意以下事项,以免发生 DNA 污染:
1.建议阳性对照与待测样本、阴性对照在实验室的不同区域进行添加,在 qPCR 反应板上阳性对照的排布应远离待测样本和阴性对照。
2.建议使用不同的移液器添加阳性对照与待测样本、阴性对照,并使用带滤芯的枪头进行加样。
3.试剂盒开启后,阳性对照应与试剂 Mix、阴性对照分开存放。
4. qPCR 封膜时须反复压紧。
5.实验室环境须定期清除支原体。
【附录 1 可检测支原体种类】
| 序号 | 拉丁文系统名 | 序号 | 拉丁文系统名 |
| 1 | Acholeplasma hippikon | 61 | Mycoplasma synoviae |
| 2 | Acholeplasma laidlawii | 62 | Mycoplasma testudineum |
| 3 | Acholeplasma oculi | 63 | Mycoplasma testudinis |
| 4 | Acholeplasma pleciae | 64 | Mycoplasma timone |
| 5 | Candidatus Mycoplasma girerdii | 66 | Mycoplasma tullyi |
| 6 | Mycoplasma alkalescens | 67 | Mycoplasma verecundum |
| 7 | Mycoplasma alvi | 68 | Mycoplasma vulturii |
| 8 | Mycoplasma anseris | 69 | Mycoplasma zalophi |
| 9 | Mycoplasma anserisalpingitidis | 70 | Mycoplasmopsis agassizii |
| 11 | Mycoplasma arginini | 71 | Mycoplasmopsis alligatoris |
| 12 | Mycoplasma arthritidis | 72 | Mycoplasmopsis anatis |
| 13 | Mycoplasma auris | 73 | Mycoplasmopsis arginini |
| 14 | Mycoplasma bovoculi | 74 | Mycoplasmopsis bovirhinis |
| 15 | Mycoplasma buccale | 75 | Mycoplasmopsis canis |
| 16 | Mycoplasma canadense | 76 | Mycoplasmopsis citelli |
| 17 | Mycoplasma cloacale | 77 | Mycoplasmopsis columbinum |
| 18 | Mycoplasma conjunctivae | 78 | Mycoplasmopsis cricetuli |
| 19 | Mycoplasma crocodyli | 79 | Mycoplasmopsis cynos |
| 20 | Mycoplasma dispar | 80 | Mycoplasmopsis edwardii |
| 21 | Mycoplasma elephantis | 81 | Mycoplasmopsis felis |
| 22 | Mycoplasma enhydrae | 82 | Mycoplasmopsis fermentans |
| 23 | Mycoplasma equigenitalium | 83 | Mycoplasmopsis gallinacea |
| 24 | Mycoplasma falconis | 84 | Mycoplasmopsis mustelae |
| 25 | Mycoplasma faucium | 85 | Mycoplasmopsis pullorum |
| 26 | Mycoplasma felis | 86 | Mycoplasmopsis pulmonis |
| 27 | Mycoplasma flocculare | 87 | Mycoplasmopsis verecunda |
| 28 | Mycoplasma gallisepticum | 88 | Ureaplasma diversum |
| 29 | Mycoplasma gateae | 89 | Ureaplasma felinum |
| 30 | Mycoplasma genitalium | 90 | Ureaplasma urealyticum |
| 31 | Mycoplasma gypis | 91 | Mycoplasma feliminutum |
| 32 | Mycoplasma hominis | 92 | Mycoplasma suis |
| 33 | Mycoplasma hyopharyngis | 93 | Mycoplasma parvum |
| 34 | Mycoplasma hyorhinis | 94 | Mycoplasma wenyonii |
| 35 | Mycoplasma hyosynoviae | 95 | Mycoplasma cottewii |
| 36 | Mycoplasma imitans | 96 | Mycoplasma putrefaciens |
| 37 | Mycoplasma indiense | 97 | Mycoplasma yeatsii |
| 38 | Mycoplasma leocaptivus | 98 | Mycoplasma amphoriforme |
| 39 | Mycoplasma leonicaptivi | 99 | Mycoplasma ovis |
| 40 | Mycoplasma lipophilum | 100 | Mycoplasma insons |
| 41 | Mycoplasma marinum | 101 | Mycoplasma erythrodidelphis |
| 42 | Mycoplasma moatsii | 102 | Mycoplasma bradburyae |
| 43 | Mycoplasma mobile | 103 | Mycoplasma haemolama |
| 44 | Mycoplasma nasistruthionis | 104 | Mycoplasma coccoides |
| 45 | Mycoplasma neophronis | 105 | Mycoplasma kahanei |
| 46 | Mycoplasma orale | 106 | Mycoplasma seminis |
| 47 | Mycoplasma ovipneumoniae | 107 | Mycoplasma phocoeninasale |
| 48 | Mycoplasma oxoniensis | 108 | Mycoplasma phocoenae |
| 49 | Mycoplasma penetrans | 109 | Mycoplasma miroungirhinis |
| 50 | Mycoplasma phocicerebrale | 110 | Mycoplasma seminis |
| 51 | Mycoplasma phocidae | 111 | Mycoplasma hyopneumoniae |
| 52 | Mycoplasma pirum | 112 | Spiroplasma citri |
| 53 | Mycoplasma pneumoniae | 113 | Mycoplasma capricolum |
| 54 | Mycoplasma pulmonis | 114 | Mycoplasma corogypsi |
| 55 | Mycoplasma salivarium | 115 | Mycoplasma procyoni |
| 56 | Mycoplasma sp. Phocoena | 116 | Mycoplasma iguanae |
| 57 | Mycoplasma sphenisci | 117 | Mycoplasma feriruminatoris |
| 58 | Mycoplasma struthionis | 118 | Mycoplasma hafezii |
| 59 | Mycoplasma sualvi | 119 | Mycoplasma buteonis |
| 60 | Mycoplasma subdolum | 120 | Mycoplasma mycoides |
【附录 2 样本直扩的操作方法】
样本的简易快速制备方案(直扩):可用于细胞培养上清、细胞悬液、血液,样本制备步骤如下:
1.细胞培养上清:取 1~1.5 mL 细胞培养上清;500 rpm 离心 3 min;取 2 µL 上清作为模板进行qPCR 反应。
2.细胞悬液:取 2 µL 细胞悬液作为模板进行qPCR 反应。要求样本内细胞总数量不超过 10000 个,样本可用细胞培养基稀释。
3.血液:取血液样本作为模板进行 qPCR 反应。注意血液中的细胞对 PCR 反应有较强抑制作用,内参检测通道会显示异常。建议用无菌水稀释 10 倍,充分混匀后,取 2 µL作为模板进行 qPCR 反应。



评价
目前还没有评价