您的购物车目前是空的!
端粒绝对长度-检测试剂盒
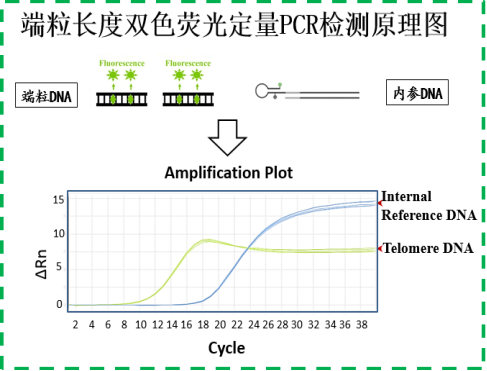
端粒(Telomeres):是真核生物线性染色体末端的非编码串联重复性(TTAGGG)n阵列,端粒长度的变化,与衰老、癌症、或神经退行性等多种疾病相关。qPCR法是检测端粒长度的经典技术,用时短,操作简单,结果准确,适用于批量样本检测。
本产品采用双色荧光 qPCR(SYBRgreen+VIC)检测端粒长度,检测对象为血液、细胞DNA。相关信息见参考文献【1】。端粒长度数据呈现两种方式:相对长度(T/S)和平均端粒长度(bp)。
描述
端粒绝对长度-检测试剂盒
【产品规格】
TL50-02 50*3 Reactions
【产品说明】
端粒(Telomeres):是真核生物线性染色体末端的非编码串联重复性(TTAGGG)n阵列,端粒长度的变化,与衰老、癌症、或神经退行性等多种疾病相关。qPCR法是检测端粒长度的经典技术,用时短,操作简单,结果准确,适用于批量样本检测。
本产品采用双色荧光 qPCR(SYBRgreen+VIC)检测端粒长度,检测对象为血液、细胞DNA。相关信息见参考文献【1】。端粒长度数据呈现两种方式:相对长度(T/S)和平均端粒长度(bp)。
 该试剂盒具有以下特点:
该试剂盒具有以下特点:
1.方便:操作简单。
2.可靠:端粒与内参单管检测,减少孔间
干扰。内参基因为多拷贝,与端粒量差降低。
3.准确:引入已知端粒绝对长度的标准品和
校正品,一个用于构建标准曲线,一个用于校正,可同时获得样品的相对长度(T/S)和绝对长度。
【运输及保存条件】
低温冷冻运输,-20 ℃保存,有效期 1年,冻融不超过3次。
【产品组分】
1.
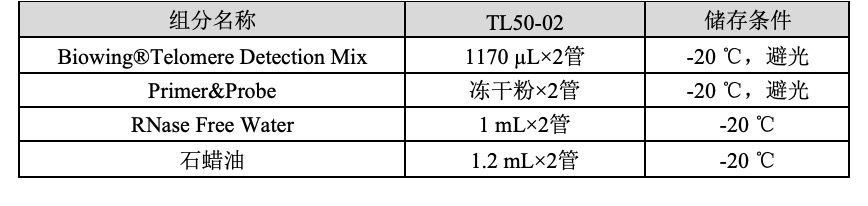
Primer&Probe 先12000 rpm离心5 min,每管再用775 µL RNase Free Water复溶。
2. 本试剂盒提供的试剂,使用前请上下轻柔颠倒十次混匀,后低速离心、小心开启。避免起泡。实验时,操作须全程在冰上进行。
3. 实验除上述组分外,标准品和校正品需要在本公司单独购买(货号:TL3-S&C),其中标准品用于构建标准曲线,校正品用于获得校正系数,标准品和校正品具体算法见附录3);DNA纯化液和DNA片段筛选功能磁珠也需要在本公司单独购买(货号:TL50-P),用于纯化DNA。
【操作步骤】
1.样品准备及质控(见附录1)
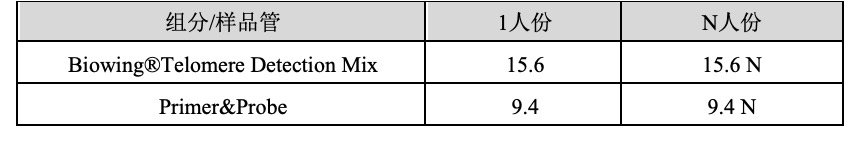
2.qPCR反应液的准备
1.根据所要检测样品的数量,计算所需反应孔数,每个样本做3 个重复孔。
反应孔数=标准品× 3个梯度× 3+(校正品+样本数)× 3(标准曲线法)
或反应孔数=标准品× 3+ 样本数× 3(△△Ct法)
2.根据反应孔数计算所需的 Mix 总量(含有 1孔的加样损失量):
Mix =(反应孔数+1)× 25 µL
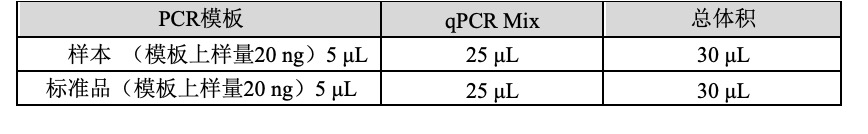
3.各试剂放室温条件下融化,并根据下表所示准备 qPCR Mix:
3.加样
- 震荡混匀 qPCR Mix,低速离心,将管盖残留液体收集至管底。
- 向每孔反应管中分装25 µL qPCR Mix。
- 向已分装过 qPCR Mix 的反应管中加入15 µL石蜡油。
- 向反应管中穿过石蜡油层加入样品后短暂离心,加样示例如下:
标准曲线法:
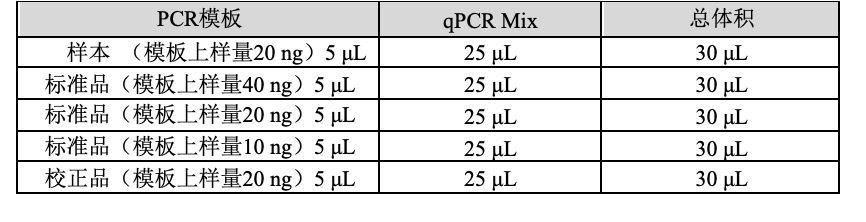
△△Ct法:
注:盖上八联管盖或者光学膜后盖上反应管盖子或者贴上光学膜,为避免影响荧光信号读取,请注意不要在管盖或者膜上做标记,或者用刮板反复摩擦。
4.qPCR反应条件
PCR仪设置以 宏石SLAN 96S 为例,其他型号定量PCR仪应通过标准品进行参数校正或咨询专业技术人员。
【阈值设置】
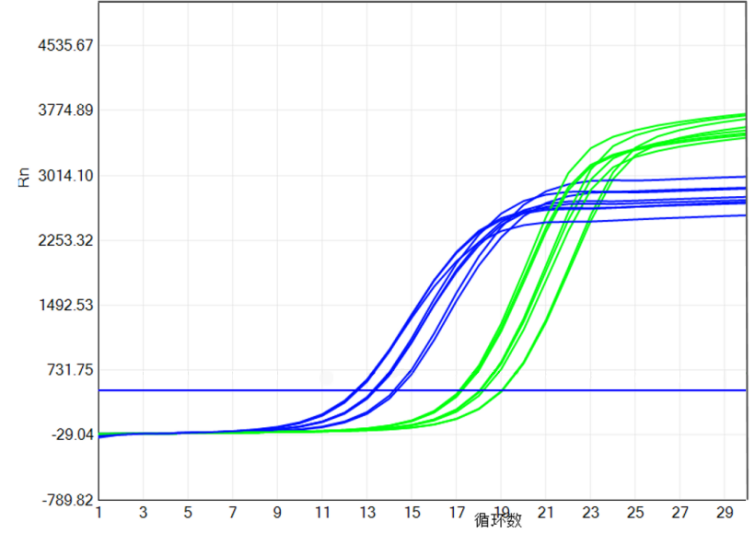
1. 以宏石SLAN-96S为例,扩增曲线算法选择绝对荧光值法,基线设置在2-7个循环。
2. 阈值的设定要保证样本及标准品的3重复的△Ct在0.3以内。
3. 阈值设定:内参和端粒扩增曲线阈值拉同一根线,都定为700;40 ng 标准品端粒的Ct值定为13±1,内参的Ct值定为18±1;标准品端粒和内参的△Ct为5±0.5。
4. 阈值设置以后,如下图所示,标准品 3个浓度梯度之间呈现较好的Ct差异,端粒通道和内参通道的△Ct均在0.8左右。
说明:
根据标准品标准曲线,若R2<0.99,表明操作有误。
备注:
1. 标准品、校正品的绝对长度,请咨询上海翼和应用生物技术有限公司。产品批次不同,绝对长度会有差异。
2. 如果检测样本为血液DNA,可以将所得端粒相对长度在上海翼和应用生物技术有限公司构建的5000例中国人群数据库比对,评估样本个体端粒的相对长度;若选用其他样本,建议自行构建数据库并做进一步分析。
3. 端粒长度计算方法见附录3。
附录 1
样本及标准品准备和质控
1.样品前处理
1.1血液样本
血液样本建议在﹣20℃保存,本试剂盒支持从淋巴细胞中分选的白细胞或血液经红细胞裂解液处理分选的白细胞进行核酸抽提,建议采用天根的血液基因组DNA提取试剂盒(DP348)抽提DNA,用于后续端粒长度的检测。
1.2细胞样本
建议采用天根的血液/细胞/组织基因组DNA 提取试剂盒(DP304)抽提DNA,用于后续端粒长度的检测。
1.3 唾液样本
唾液样本需要细胞分选再抽提DNA,分选操作较复杂,建议咨询本公司技术人员。
2.样本质量的标化
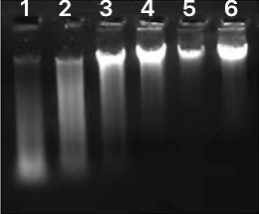
端粒长度的测定与样本质量相关性较大,DNA质量要求较高,需要对样本及标准品DNA纯化,保证样本的均一化。样本DNA经DNA纯化液处理(37 ℃ 金属浴30 min,90 ℃ 金属浴2 min)后,可根据样品的质量分别采用磁珠分选或割胶回收的方法,具体参考如下:
(1)磁珠分选方法:经DNA纯化液纯化后,如果样本DNA质量较好(参考下图泳道4-6),采用磁珠分选方法。详细纯化DNA步骤见端粒长度 DNA纯化试剂盒说明书。
(2)割胶回收方法:经DNA纯化液纯化后,如果样本DNA质量较差(参考下图泳道1-3),采用割胶回收方法。具体操作:取1 µg样本进行0.7-0.8%琼脂糖凝胶电泳后,使用TaKaRa MiniBEST Agarose Gel DNA Extraction Kit Ver.4.0(9762)回收纯化DNA片段,回收效率10%-30%,和基因组DNA的完整程度有关。
- 样本浓度的标化
3.1△△Ct法
磁珠分选样品:样本和标准品标化至4 ng/µL,上样5 µL,通过△△Ct法计算端粒长度。
3.2 标准曲线法
方法一:经磁珠分选的样本DNA浓度标化至4 ng/µL,上样5 µL。标准品的DNA浓度标化至8 ng/µL,按2倍和4倍梯度稀释后,上样5 µL,用于构建标准曲线(3个梯度的DNA总上样量分别为40 ng、20 ng、
10 ng)。校正品的DNA浓度标化至4 ng/µL,上样5 µL,用于校正。具体计算详见附录3。
标准品具体稀释方法见下图,连续的稀释方法得到标准曲线R2需达到0.99以上。
方法二:经割胶回收的样本、标准品和校正品浓度标化方法同上。

注:样品及标准品的浓度过高或过低会影响扩增效率,对实验造成干扰,测量结果误差较大。
附录 2
割胶回收推荐使用TaKaRa MiniBEST Agarose Gel DNA Extraction Kit Ver.4.0(9762),具体操作详见说明书。
附录 3
结果与计算
方法一:△△Ct法
端粒长度计算方法(T/S):先分别计算标准品与样品的△Ct=Ct(端粒)-Ct(内参)
再计算 T/S=2-(△Ct(样品)-△Ct(标准品))
注:T为待测样品,S为标准品,T/S为待测样品与标准品的端粒相对长度比
绝对长度=标准品长度*T/S
方法二:标准曲线法
1.标准曲线的构建
以标准品 3个浓度梯度下的平均Ct值为横坐标,3个梯度的Log2上样量为纵坐标,构建标准曲线。
表1 标准品端粒通道Ct值

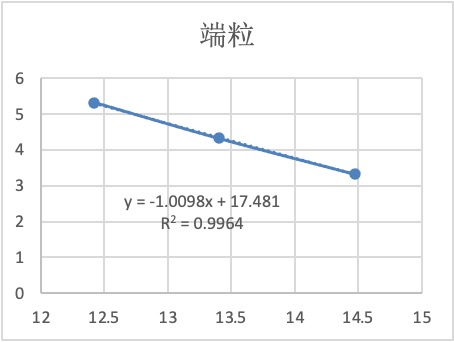
表2 标准品内参通道Ct值

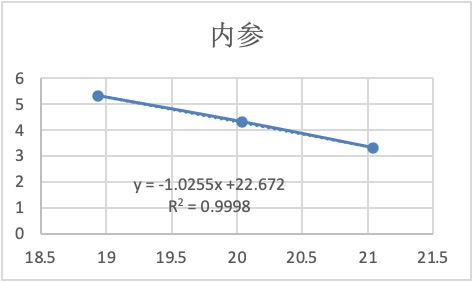
2.利用标准品标准曲线计算校正品的T/S
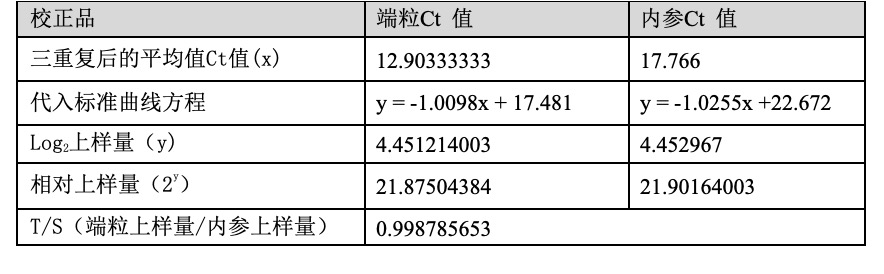
将校正品的端粒和内参通道的Ct 值带入标准曲线方程,即可得到校正品的T/S。
表3 校正品的T/S计算过程
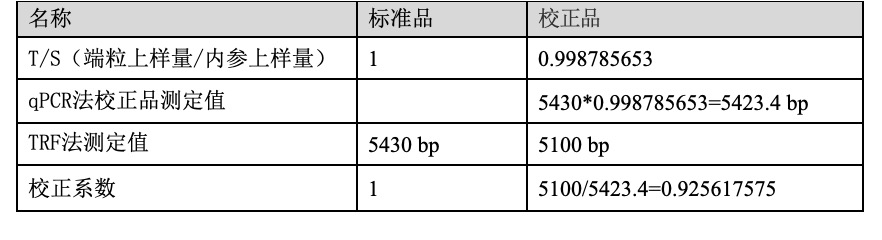
3.校正系数的计算
已对标准品和校正品的端粒长度做TRF检测,绝对端粒长度已知(假定标准品的绝对长度为5430 bp,校正品的绝对长度为5100 bp),按照下图示即可得到用于校正样品的校正系数。
表4 校正品的校正系数
4.样本T/S以及绝对长度的计算
表5 样本的T/S计算
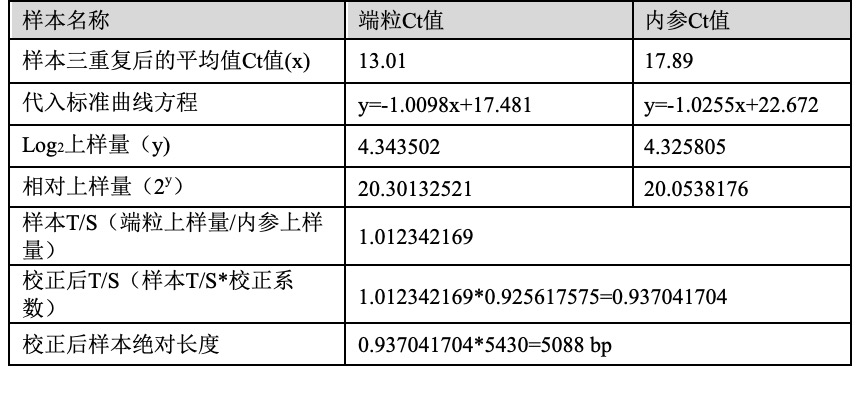
注:本表中校正系数源自表4中计算出的校正系数,本表中标准品绝对长度为5430 bp
附录4
相关产品
参考文献:
【1】Sun G, Cao H, Bai Y, Wang J, Zhou Y, Li K, Xiao JH. A novel multiplex qPCR method for assessing the comparative lengths of telomeres. J Clin Lab Anal. 2021 Sep;35(9):e23929. doi: 10.1002/jcla.23929. Epub 2021 Aug 4. PMID: 34347924; PMCID: PMC8418462.


评价
目前还没有评价